|
N. Uyeda, T. Kobayashi, K. Ishizuka and Y. Fujiyoshi Chemica Scripta., 14, 47-61 (1978/79).
|
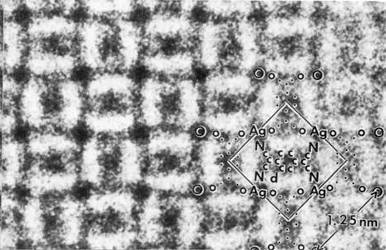
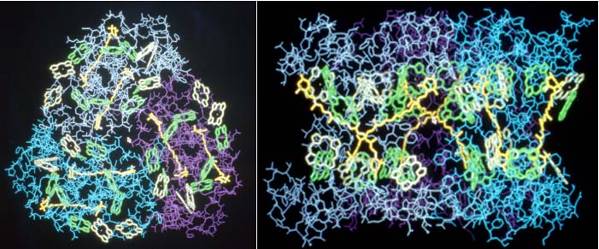
| 電 子顕微鏡で分子構造が直接観察できることが、塩化フタロシアニン銅の結晶を用いて始めて証明された。加速電圧500kVの電子顕微鏡を使用して、焦点条件 や非点条件、対物レンズの伝達関数の減衰条件などの分解能に関わる因子を最適化することによって、1.8Å分解能で銅原子や塩素原子列などが直接観察され た。 |
|
塩化フタロシアニン銅の像。はめ込まれた化学構造から分かるように銅原子や塩素原子列が直接観察される。 |
|
2. Crystal Structure of Ag-TCNQ. N. Uyeda, T. Kobayashi, K. Ishizuka and Y. Fujiyoshi Nature, 285, 95-97 (1980).
|
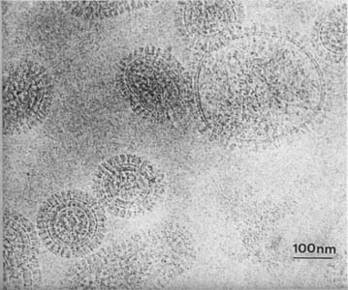
| Minimum Dose System(MDS)を開発することによって、視野探しや焦点合わせなどのために照射される電子線量を最少にして、電子線損傷を受けやすい試料でも原子 レベルの分解能の像が撮影できるようになった。MDS用いて、電荷移動錯体であるAg-TCNQ.の原子レベルの像が観察された。 |
|
MDSを用いて撮影されたAg-TCNQの像。銀原子やキノン環が直接観察される。 |
|
3. Holes in a Stearic Acid Monolayer Observed by Dark-Field Electron Microscopy. N. Uyeda, T. Takenaka, K. Aoyama, M. Matsumoto and Y. Fujiyoshi Nature, 327, 319-321 (1987).
|
| 気 液界面に両親媒性の単分子膜を作製するいわゆるLangmuir-Blodgett膜(LB膜)には穴が存在しているので、それまで界面化学分野において 考えられていた、Pressure(p)-area(A)曲線を単純に解釈出来ないことを、暗視野電子顕微鏡像を撮影して証明した。LB膜分野には衝撃的 なことであったために、多くの反論があったが、現在ではこの様な膜に欠陥が出来ることは一般に認められるようになったと思われる。 |
|
4. Development of a Superfluid Helium Stage for High-Resolution Electron Microscopy. Y. Fujiyoshi, T. Mizusaki, K. Morikawa, H. Yamagishi, Y. Aoki, H. Kihara and Y. Harada Ultramicroscopy, 38, 241-251 (1991).
|
| ヘ リウム温度に冷却できて(実際には超流動状態のヘリウムを用いて1.5Kまで冷却可能)、高分解能(2.6Å分解能)の像が撮影できる極低温電子顕微鏡の 開発について書いた極低温電子顕微鏡に関する歴史的論文。この装置は1986年に開発したが、その後5年ほどかけて、問題が生じないかなど十分に検討した 後に論文とした。 |
 |
| 4.2Kに冷却して極低温電子顕微鏡で撮影された塩化フタロシアニン銅の像(左)とその光変換像(右)これから、分解能が2.6Åであることがとわかる。なお、極低温電子顕微鏡の分解能は、現在2.0Åに改善されている。 |
|
5. Fine Structure of Influenza A Virus Observed by Electron cryo-Microscopy. Y. Fujiyoshi, N. P. Kume, K. Sakata and S. B. Sato EMBO Journal,13, 318-326 (1994).
|
| 極低温電子顕微鏡を用いて、氷に包埋したインフルエンザウィルスの像を撮影した結果、感染性の高いインフルエンザウィルスは、脂質2重膜ではなくて、脂質1重膜にM蛋白質が裏打ち状の構造を形成した驚くべき構造を有することがわかった。 |
|
氷包埋で撮影されたインフルエンザウィルスの像。密度の高い粒子は脂質2重膜ではなく脂質1重膜にM蛋白質が裏打ちした構造であることがわかる。 |
|
6. Atomic Model of Plant Light-Harvesting Complex by electron crystallography. W. Kühlbrandt, Da Neng Wang and Y. Fujiyoshi Nature, 367, 614-621 (1994).
|
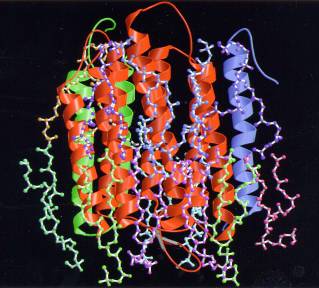
| 光 合成アンテナ蛋白質の2次元結晶の像を極低温電子顕微鏡を用いて撮影し、3.4Å分解能での解析から原子モデルを作製した。光のエネルギーを光合成反応中 心に効率よく集めるアンテナ機構などが解明された。液体窒素温度に試料を冷却できる電子顕微鏡を用いて解析された分解能が6Åに制限されていたが、ヘリウ ム温度に冷却できる極低温電子顕微鏡を用いることによって、分解能が3.4Åに向上して原子モデルが解析された。この論文により、極低温電子顕微鏡が高分 解能の構造解析に有用なことが認識され始めた。 |
 |
| 電子線結晶学で解析された、アンテナ蛋白質の構造。膜面に垂直方向からみた構造(左)と膜面に平行方向からみた構造(右)。 |
|
7. Three-Dimensional Structure of Aquaporin 1. T. Walz, T. Hirai, K. Murata, B. L. Smith, J. B. Heymann, K. Mitsuoka, Y. Fujiyoshi, P. Agre and A. Engel Nature, 387, 624-627 (1997). |
| ヒトの赤血球から精製された水チャネル、アクアポリンー1の2次元結晶を作製し、6Å分解能で解析。その結果、6本のヘリックスが右巻きのヘリカルバンドルを形成していることに加えて、Xと命名したもう1つのコントラストが観察された。 |
|
8. Surface of Bacteriorhodopsin Revealed by High-Resolution Electron Crystallography. Y. Kimura, D. G. Vassylyev, A. Miyazawa, A. Kidera, M. Matsushima, K. Mitsuoka, K. Murata, T. Hirai and Y. Fujiyoshi Nature, 389, 206-211 (1997).
|
| 光 のエネルギーを用いてプロトンを細胞内から細胞外へポンピングする膜蛋白質、バクテリオロドプシンの構造が高分解能(3.0Å分解能)で解析された。その 結果、細胞外側にb-sheet構造を有することが確認された。またこの分子と規則的に相互作用している脂質8分子も観察された。細胞内外の表面構造をも 精度良く解析できたことによって、効率よくプロトンをポンピングする分子機構のモデルを提案した。 |
|
電子線結晶学で解析されたバクテリオロドプシンの構造。3.0Å分解能の解析によってループ部分の構造も基本的に解析された。 |
|
K. Mitsuoka, T. Hirai, K. Murata, A. Miyazawa, A. Kidera, Y. Kimura and Y. Fujiyoshi J. Mol. Biol.,286, 861-882 (1999).
|
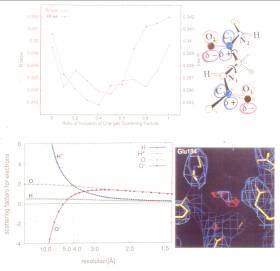
| 3.0Å 分解能で解析されたバクテリオロドプシンの構造を精密化した。電子線の原子散乱因子はX線のそれとは異なることから、電子線結晶学では電荷の移動が半定量 的に解釈できる可能性があることを示した。例えば、カルボニル基に45%の電荷移動を入れたときに結晶学的なR因子が最良になることを示した。通常、主鎖 のカルボニル基は45%程度の電荷移動があるとされていることと良く一致する。 |
|
電子線の原子散乱因子はX線とは異なり、電荷によって大きな影響を受ける。例えば、水素原子が正に帯電すると4.5Åより底角側の原子散乱因子は酸素より大きくなる。それゆえ、電子線結晶学におけるポテンシャルマップは、電荷移動の影響を受けたものとなる。 |
|
10. Structural determinants of water permeation through aquaporin-1. K. Murata, K. Mitsuoka, T. Hirai, T. Walz, P. Agre, J. B. Heymann, A. Engel and Y. Fujiyoshi Nature, 407, 599-605 (2000).
|
| ヒ トの赤血球から精製されたアクアポリンー1の3.8Å分解能での解析から、水チャネル発見以後の研究で出てきた疑問に構造学的な視点から答えることが出来 た。すなわち、1)水銀イオンによる水透過阻害機構、2)水だけを選択的に透過し、イオンや小さい溶質などを通さない高い水選択機構、3)1秒間に1つの チャネルで20億もの水分子を透過できる速い水透過機構、4)速い水透過を行いながら、プロトンの透過を阻害する機構を分子レベルから説明することが出来 た。水チャネルの発見と、この様な水チャネルの選択透過機構の解明によって、共同研究者のPeter Agre博士が2003年のノーベル化学賞を受賞した。 |
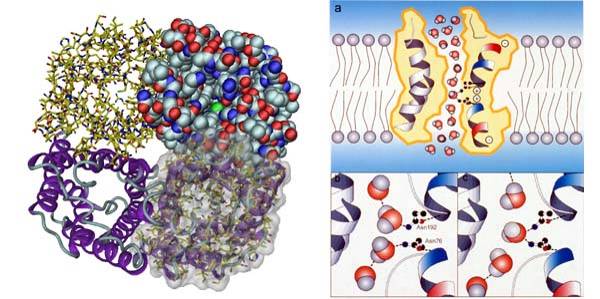 |
| 水チャネル、アクアポリンー1の4量体の構造(左)とプロトンをも阻害する高い水選択性を実現しながら、速く水を透過できる機構を説明した図(右)。 |
|
11. The voltage-sensitive sodium channel is a bell-shaped molecule with several cavities. C. Sato, Y. Ueno, K. Asai, K. Takahashi, M. Sato, A. Engel and Y. Fujiyoshi Nature,409, 1047-1051 (2001).
|
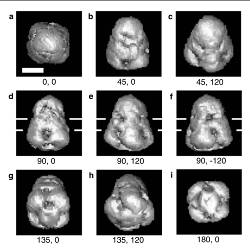
| 極低温電子顕微鏡を用いて、電気ウナギの発電器官から精製した電圧感受性Na+-channelを氷包埋法で撮影した。極低温電子顕微鏡像と単粒子解析法を用いて、電圧感受性Na+-channelの構造が解明された。分解能は低いが、この解析から、電圧感受性Na+-channelは膜貫通部位の両側にVestibulesとよぶ穴を有するベル型の分子であることが明らかになった。 |
|
単粒子解析法で構造解析された電圧感受性Na+-channelの構造。図d, e, f に表示される白い2本線は脂質2重膜を示す。 |
K. Irie, T. Nakatsu, K. Mitsuoka, A. Miyazawa, K. Sobue, Y. Hiroaki, T. Doi,
Y. Fujiyoshi and H. Kato
J. Mol. Biol., 318, 1117-1126 (2002).
|
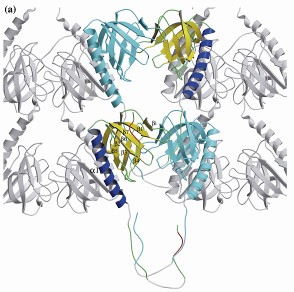
| シ ナプス後膜に存在する代謝型グルタミン酸受容体などの局在化に関わる足場蛋白質Homerの保存されている部分のX線結晶構造解析を行った。 Homer1cを単独で発現した場合にはクラスターを形成しないが、グルタミン酸受容体と共発現するとHomer1cは受容体と共にクラスターを形成す る。この様なクラスターの形成機構にはスイッチング機構が必要とされるが、構造解析に基づいてこのスイッチング機構のモデルを提案した。 |
|
X線結晶学で解析されたHomerファミリーで保存されている部分の構造。Pドメインと名付けた部分がEVHドメインに結合した構造。 |
|
13. Structure and gating mechanism of the acetylcholine receptor pore. A. Miyazawa, Y. Fujiyoshi and N. Unwin
Nature, 423, 949-955 (2003).
|
| 神 経筋接合部に存在するアセチルコリン受容体の構造は、電気エイの発電器官から精製したニコチン性アセチルコリン受容体を用いてNigel Unwin博士が長年研究してきた。極低温電子顕微鏡を用いて、チューブ状結晶の多くの像を撮影することによって、ついに原子モデルが作製できた。この解 析から、5本のM2と呼ばれるヘリックスがチャネルを形成し、5量体のそれぞれのサブユニットはM1,M3,M4と名付けられた膜貫通ヘリックスを有し、 計15本がM2ヘリックスを脂質分子から隔離して回転運動を可能にする余地を与える構造が明らかになった。チャネルの一番狭い部分は、完全に疎水的なアミ ノ酸残基で直径6Åの“穴”になっており意外に大きい。しかし、水和したイオンの直径が8Å程度であることから、この径の穴をイオンは透過できない。この 比較的大きな“穴”は、閉じた状態からM2ヘリックスを僅かに回転させるだけで素早くイオンを透過出来るようになるので、速い情報伝達(速いゲーティング によるイオンの透過制御)には最適な構造であると思われる。この原子モデルとリガンド結合状態での低い分解能での構造解析などから、このタイプの受容体の ゲーティング機構が提案出来るようになった。すなわち、リガンド結合ドメインにアセチルコリンが結合すると、内側のbシートが10度程右回転する。その内 側のbシートの下端に存在する46番のバリンがM2ヘリックスの上端に接しており、それによってaサブユニットのM2がおよそ10度右回転させられる。す るとこのファミリーの蛋白質において保存されているロイシンが隣り合うM2ヘリックスのアラニンやセリンと形成していたガードル構造が壊れて、狭い穴の部 分がおよそ9Åに拡がる。この様な機構でこの受容体は素早くイオンを透過することが出来る。 |
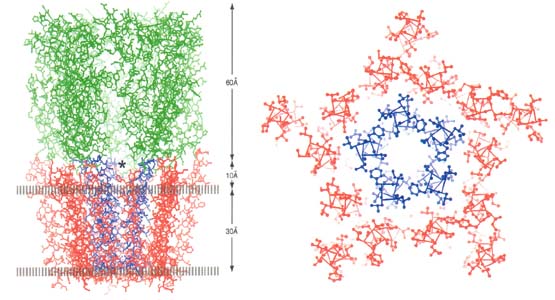 |
| 膜面に平行方向から見たアセチルコリン受容体の構造(左)と膜面に垂直方向から見た膜貫通部分の構造(右) |
|
14. Inositol 1,4,5-trisphosphate receptor contains multiple cavities and L-shaped ligand-binding domains. C. Sato, K. Hamada, T. Ogura, A. Miyazawa, K. Iwasaki, Y. Hiroaki, K. Tani, A. Terauchi,
Y. Fujiyoshi and K. Mikoshiba
J. Mol. Biol. 336, 155-164 (2004).
|
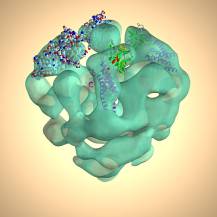
| 細胞内カルシウム濃度を制御するIP3受容体がカルシュウムを結合していない条件にある時の構造が、極低温電子顕微鏡と単粒子解析法を用いて解析された。その結果、この分子は気球の様な形をした多孔性の構造で、膜貫通部位の上下にも“穴”があり、電圧感受性Na+-channelやアセチルコリン受容体などと同じようにVestibulesを有する構造であることが解明された。IkuraらによりX線で解析されたIP3結合ドメインを、この単粒子解析で解析された立体構造にみられるL型の密度にアサインすることが出来た。 |
|
X線結晶学で解析されたIP3結合ドメインの構造(Ikura等)を、単粒子解析で解析されたIP3受容体の立体構造にはめ込んだ構造。 |
|
(Reviews) The Structural Study of Membrane Proteins by Electron Crystallography. Y. Fujiyoshi Adv. Biophys., 35, 25-80 (1998)
|
| 極低温電子顕微鏡の開発の歴史を始め、個人的研究経緯を技術的側面も含めて解説。 |